Projects

PROJECT 1
『代謝制御と細胞作製』プロジェクト
ヒトiPS細胞から心筋細胞を作製し、心臓病の患者に移植する心臓再生医療の実現化を目指して長年研究を行っています。その際に重要となるのが、分化後に心筋以外の細胞が混入することによる“腫瘍化”の問題です。
この課題に対して、細胞種ごとの代謝機構の違いに着目した『培養液を利用した簡便な心筋純化精製法』を世界で初めて確立し、克服することに成功しました (Cell Stem Cell 2013, Cell Metabolism 2016, Circulation Research 2017)。また、腫瘍化の原因細胞である未分化幹細胞において、脂肪酸合成経路が活性化していることに着目し、『脂肪酸合成酵素阻害による未分化幹細胞の選択的除去法』を開発しました (iScience 2020, STAR Protocols 2022a)。その他にも、トリプトファン代謝を制御することにより、『ヒトiPS細胞における増殖を促進させる方法』を開発しています (iScience 2021, STAR Protocols 2022b)。
今後はさらに、代謝制御により効率よく心筋細胞に分化させる方法や成熟させる方法の構築を目指します。
“Metabolism-Based Cell Production” Project
We have been working on the realization of cardiac regenerative medicine, in which cardiomyocytes are produced from human iPSCs and transplanted into patients with heart disease. One of the key issues in this process is the problem of “tumorigenesis” caused by the presence of residual undifferentiated iPSCs after differentiation.
To overcome this issue, we established “world-first metabolic selection systems for cardiomyocytes using special culture medium” that focuses on the differences in metabolic mechanisms of different cell types and succeeded in overcoming this issue (Cell Stem Cell 2013, Cell Metabolism 2016, Circulation Research 2017). In addition, focusing on the fact that the fatty acid synthesis pathway is activated in undifferentiated iPSCs, which are the cells responsible for tumorigenesis, we developed “a method for selective removal of undifferentiated iPSCs by fatty acid synthase inhibition” (iScience 2020, STAR Protocols 2022a). In addition, we have developed “a method to promote proliferation of human iPSCs by controlling tryptophan metabolism” (iScience 2021, STAR Protocols 2022b).
In the future, we will further aim to refine methods to efficiently differentiate and mature human iPSCs into cardiomyocytes through metabolic control.
PROJECT 2
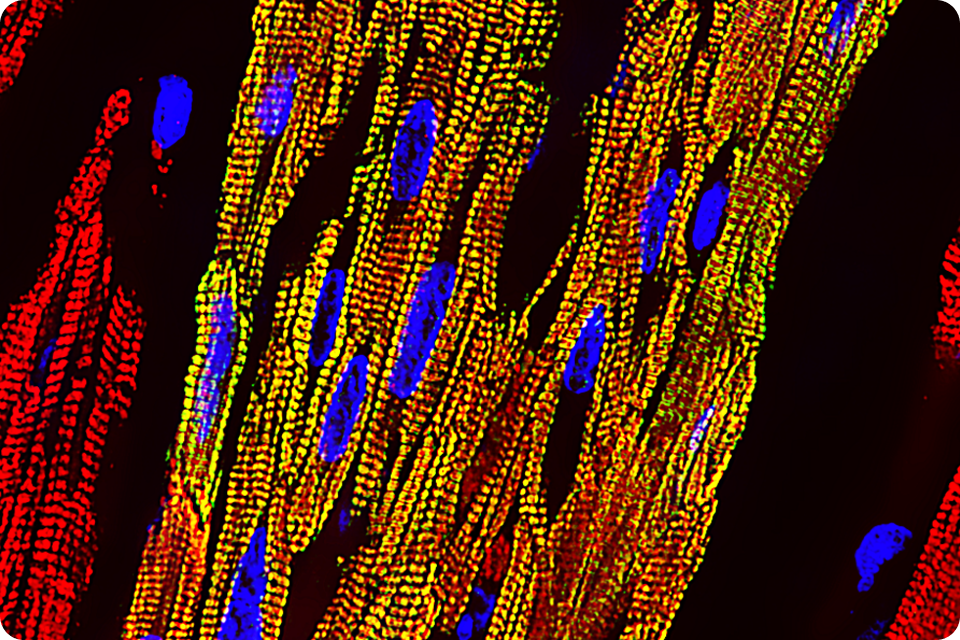
『心筋再生』プロジェクト
重症心不全の患者に対する新しい治療法として、心臓再生医療の実現化を目指して研究を行っています。
ヒトiPS細胞から高純度の心筋細胞を大量に作製し (Stem Cell Reports 2017)、微小な心筋組織球を形成した後に (J Heart Lung Transplant 2019)、心不全モデル動物の心臓に移植することで、移植細胞が効率よく生着し、心臓の機能が改善すること、移植後の不整脈の発生が最小限に抑えられることを示してきました (J Am Coll Cardiol_BTS 2021, Circulation 2024)。また、移植後に生着した心筋細胞はホスト心臓においてサルコメア構造だけではなく、代謝的にも成熟することを明らかにしてきました (iScience 2024)。さらに、培養上清を用いて移植細胞の品質を評価する手法の確立等を行っています (Stem Cell Reports 2023)。
現在は、関連企業と連携し、虚血性心筋症の患者への心筋組織球移植に関する治験実施しています。
“Cardiac Regeneration” Project
We have produced a large number of highly purified cardiomyocytes from human iPSCs (Stem Cell Reports 2017), formed cardiac spheroids (J Heart Lung Transplant 2019), and transplanted them into the hearts of animal models with heart failure. As a result, the transplanted cells were efficiently engrafted, and the cardiac function was improved with limited post-transplant arrhythmia (J Am Coll Cardiol_BTS 2021, Circulation 2024). We have also shown that engrafted cardiomyocytes metabolically matured as well as sarcomere structures in the host heart (iScience 2024). Furthermore, we have established a method to evaluate the quality of transplanted cells using culture supernatants (Stem Cell Reports 2023).
Currently, in collaboration with a venture company, we are conducting a clinical trial on human iPSC-derived cardiac spheroids transplantation for patients with ischemic cardiomyopathy (LAPiS Study, NCT04945018).
PROJECT 3
『心臓オルガノイド・心筋組織作製』プロジェクト
創薬研究や疾患病態解明研究のための基盤技術を構築するため、培養皿の中で成体に近い心臓オルガノイドや心筋組織を作製する研究を行っています(Cell Reports Methods 2023, Biomaterials 2023, Advanced Science 2023, Advanced Healthcare Materials 2024)。
“Cardiac Organoids and Tissues Production” Project
To establish foundational technologies for research on drug discovery and disease pathophysiology, we are working on the production of adult-like cardiac organoids and tissues in culture dishes (Cell Reports Methods 2023, Biomaterials 2023, Advanced Science 2023, Advanced Healthcare Materials 2024).
PROJECT 4
『創薬・疾患研究』プロジェクト
これまでに開発してきた心筋細胞を含む分化細胞の作製技術や心臓オルガノイド・心筋組織作製技術を利用することで、創薬研究や疾患病態解明に関する研究を行っています。
“Drug Discovery and Disease Research” Project
By utilizing the technologies we have developed to produce differentiated cells, including cardiomyocytes, cardiac organoids and tissues, we are conducting research on drug discovery and elucidation of pathophysiology of diseases.
